कार्बनिक रसायन
कार्बनिक रसायन (अंग्रेज़ी: Organic Chemistry) रसायन विज्ञान की एक तीन प्रमुख शाखाओं में से एक है। दूसरी प्रमुख शाखा अकार्बनिक रसायन और तीसरी भौतिक रसायन है। कार्बनिक रसायन का सम्बन्ध मुख्यतः कार्बन और हाइड्रोजन के अणुओं वाले रासायनिक यौगिकों के संरचना, गुणधर्म, रासायनिक अभिक्रियाओं एवं उनके निर्माण (संश्लेषण या सिन्थेसिस एवं अन्य प्रक्रिया द्वारा) आदि के वैज्ञानिक अध्ययन से है। कार्बनिक यौगिकों में कार्बन और हाइड्रोजन के अतिरिक्त अन्य अणु भी हो सकते हैं, जैसे- नाइट्रोजन (नत्रजन), ऑक्सीजन, हैलोजन, फॉस्फोरस, सिलिकॉन, गंधक (सल्फर) आदि।
संयोजकताएँ
संयोजकताएँ (जिनके द्वारा अणु में परमाणु एक दूसरे के साथ संबद्ध होते हैं) दो प्रकार की होती हैं-
- वैद्युत् संयोजकता (Electrovalency)
- सहसंयोजकता (Covalency)
अकार्बनिक लवणों में अणु में परमाणु, या मूलक, बहुधा विद्युत् संयोजकता द्वारा संबद्ध रहते हैं और ये अणु न केवल विलयनों में ही आयनों में विभक्त हो जाते हैं, बल्कि ठोस क्रिस्टलों में भी इनके आयन विशेष स्थिति में विद्यमान् रहते हैं। कार्बन परमाणु की बाह्यतम परिधि पर चार इलेक्ट्रॉन (.) हैं। यह अपने चारों ओर चार और इलेक्ट्रॉन लेकर अपना अष्टक पूरा कर सकता है। एक कार्बन परमाणु इस प्रकार चार हाइड्रोजनों से भी संयुक्त हो सकता है, या क्लोरीन के चार परमाणुओं से। यह संयोजन विद्युत् संयोजन से भिन्न है। न तो कार्बन टेट्राक्लोराइड विलयनों में विभाजित होकर क्लोराइड आयन देता है और मेथेन विभाजित होकर हाइड्रोजन आयन। दो दो इलेक्ट्रॉनों के भागीदार बनने पर एक एक बंध बनता है। अत: कार्बन की सहसंयोजकता 4 है। कई कार्बन परमाणु भी सहसंयोजकताओं द्वारा आपस में उत्तरोत्तर क्रम से संयुक्त हो सकते हैं। इसी प्रकार साइक्लोपेंटेन, का5हा10 (C5H10), में 5 कार्बनों का बंद वलय, और साइक्लोहेक्सेन, का6हा12 (C6H12), में 6 कार्बनों का बंद वलय है।
कभी कभी अणुओं में असंतृप्त संयोजकताएँ होती हैं। यदि दो कार्बन परमाणुओं के बीच में 4 इलेक्ट्रॉनों की भागीदारी हो, तो कहा जाएगा कि इनके बीच में एक द्विबंध है, और 6 इलेक्ट्रॉनों की भागीदारी हो तो कहेंगे कि इनके बीच में त्रिबंध हैं। एकबंध (:) द्विबंध (::) की अपेक्षा और द्विबंध त्रिबंध (:::) की अपेक्षा अधिक प्रबल है। जिन यौगिकों में द्विबंध हैं, वे अधिक अस्थायी और अधिक असंतृप्त हैं। बेन्ज़ीन, का6हा6 (C6H6), बाद वलय का एक यौगिक है। इसमें तीन द्विबंध भी माने जा सकते हैं, पर यह विशेष रूप से स्थायी है। इसके प्रत्येक दो कार्बनों के बीच का एक बंध अनुनादी माना जाता है, जिसके कारण बेन्ज़ीन वलय को विशेष स्थायित्व प्राप्त होता है। इस प्रकार के अनुनादी गुणों के कारण ऐरोमैटिक नाभिक (जैसा बेन्ज़ीन में है) ऐलिफैटिक की अपेक्षा भिन्न समझे जाते हैं। कार्बनिक यौगिकों की विशेषता उनकी विस्तृत समावयता के कारण है। एक ही अणु के विभिन्न गुणवाले अनेक यौगिक होते हैं। साइक्लोप्रोपेन और प्रोपिलीन दोनों का एक ही अणु सूत्र का3हा6 (C3H6) है। दिग्विन्यास समावयता के कारण् भी कार्बनिक यौगिकों में बहुत भिन्नता पाई जाती है। मलेइक अम्ल (सिस रूप) और फूमैरिक अम्ल (ट्रान्स रूप) में इसी कारण अंतर है। दोनों अम्लां के भौतिक और रासायनिक गुणों में अंतर है।
लैक्टिक अम्ल, कहा3. काहाऔहा. काऔऔहा (CH3. CH. OH. COOH) में एक असममित कार्बन परमाणु है। जिस कार्बन की चार संयोजकताओं से भिन्न भिन्न मूलक संयुक्त हों, वह असममित कार्बन कहलाता है। जिन अणुओं में इस प्रकार के असममित कार्बन होंगे, वे विलयनों और क्रिस्टनों में प्रकाश-घूर्णन प्रदर्शित करते हैं। इनके अणु दक्षिण-भ्रामी (द-) और वामी भ्रामी (वा-) और निष्क्रिय तीनों रूपों में पाए जा सकते हैं। 8 ऐल्डोपेंटोस और 16 ऐल्डो-हेक्से की कल्पना ही प्रस्तुत नहीं की, उन्हें पृथक् करके उनका रचना विन्यास भी स्पष्ट कर दिया। 8 पेंटोस ये हैं : लिक्सोस, ज़ाइलो, ऐरेबिनोस और रिबोस और इन चारों के दक्षिणभ्रामी और वामभ्रामी दो दो रूप। ऐल्डोहेक्सोस में 4 असममित कार्बन हैं। अत: ये 16 प्रकार के होंगे। आठ दक्षिणभ्रामी और आठ वामभ्रामी। अणुओं की रचना तीनों विमाओं में प्रसारित हैं, न केवल दो विमाओं के धरातल में। इन संरचनाओं में अनेक प्रकार की समावयवताएँ संभव हैं और कार्बनिक रसायन के अध्ययन में इन सबका महत्व है।
कार्बन और आइड्रोजन के यौगिकों को हाइड्रोकार्बन कहते हैं। मेथेन (CH4) सबसे छोटे अणुसूत्र का हाइड्रोकार्बन है। ईथेन (C2H6), प्रोपेन (C3H8) आदि इसके बाद के हैं, जिनमें क्रमश: एक एक कार्बन जुड़ता जाता है। हाइड्रोकार्बन तीन रेणियों के हैं: ईथेन रेणी, एथिलीन रेणी और ऐसीटिलीन रेणी। ईथेन रेणी के हाइड्रोकार्बन संतृप्त हैं, अर्थात् इनमें हाइड्रोजन की मात्रा और बढ़ाई नहीं जा सकती। एथिलीन में दो कार्बनों के बीच में ए द्विबंध (=) है, ऐसीटिलीन में त्रिगुण बंध (===) वाले यौगिक अस्थायी हैं। ये आसानी से ऑक्सीकृत एवं हैलोजनीकृत हो सकते हैं। हाइड्रोकार्बनों के बहुत से व्युत्पन्न तैयार किए जा सकते हैं, जिनके विविध उपयेग हैं। ऐसे व्युत्पन्न क्लोराइड, ब्रोमाइड, आयोडाइड, ऐल्कोहाल, सोडियम ऐल्कॉक्साइड, ऐमिन, मरकैप्टन, नाइट्रेट, नाइट्राइट, नाइट्राइट, हाइड्रोजन फास्फेट तथा हाइड्रोजन सल्फेट हैं। असतृप्त हाइड्रोकार्बन अधिक सक्रिय होता है और अनेक अभिकारकों से संयुक्त हा सरलता से व्युत्पन्न बनाता है। ऐसे अनेक व्युत्पंन औद्योगिक दृष्टि से बड़े महत्व के सिद्ध हुए हैं। इनसे अनेक बहुमूल्य विलायक, प्लास्टिक, कृमिनाशक ओषधियाँ आदि प्राप्त हुई हैं। हाइड्रोकार्बनों के ऑक्सीकरण से ऐल्कोहॉल ईथर, कीटोन, ऐल्डीहाइड, वसा अम्ल, एस्टर आदि प्राप्त होते हैं। ऐल्कोहॉल प्राथमिक, द्वितीयक और तृतीयक हो सकते हैं। इनके एस्टर द्रव सुगंधित होते हैं। अनेक सुगंधित द्रव्य इनसे तैयार हो सकते हैं।
काष्ठ का भंजक आसवन
लकड़ी या काष्ठ में दो पदार्थ मुख्यतया होते हैं, सेलुलोस और लिगनिन। सेलुलोस का सधारण सूत्र (का6हा10औ5)च [(C6H10O5)n] है। च (n) का मान इस सूत्र में 3,000 तक हो सता है। इस प्रकार सेलुलोस के अणु बड़े लंबे आकार के होते हैं और सेलुलोस के धागे बन सकते हैं। लिगनिन प्लास्टिक बंधक का काम करता है। इसकी रचना अज्ञात है। इसमें बेन्ज़ीन वलय, मेथॉक्सि मूलक, -औकाहा3 (-OCH3), पार्व रृंखलाएँ हैं। लकड़ी को 380° तक गरम करें तो इसमें से काफ़ी मात्रा में एक द्रव निकलता है, जिसमें ऐसीटिक अम्ल, मेथिल ऐल्कोहॉल, ऐसीटोन आदि पदार्थ होते हैं। ये पदार्थ सेल्यूलोस और लिगनिन के विभान से बनते हैं। काष्ठ के भंजक आसवन से निम्न यौगिक पृथक् किए जा सकते हैं : फॉर्मिक अम्ल, कई वसा अम्ल, असंतृप्त अम्ल, ऐसेटैल्डिहाइड, सेलिल ऐल्कोहॉल, मेथिल एथिल कीटोन, फरफरॉल, मेथिलाल, डाइमेथिल ऐसीटॉल, बेन्ज़ीन, ज़ाइलीन, क्यूमीन, सायमीन, फीनोल आदि। ऐसीटिक अम्ल, मेथिल एल्कोहॉल और ऐसीटोन, ये तीन पदार्थ पाइरोलिग्निअस अम्ल से विशेष रूप से प्राप्त किए जाते हैं। पाइरोलिग्निअस अम्ल से प्राप्त मेथिल ऐल्कोहॉल के आक्सीकरण से फॉर्मेल्डिहाइड बनता है, जिसका आविष्कारक हॉफमन था (1867 ई.)। फार्मेल्डिहाइड व्यापारिक मात्रा में तैयार करने की विधि पार्किन ने निकाली और इस पदार्थ की उपयोगिता का महत्व उत्तरोत्तर बढ़ता ही गया।
ऐल्कोहलीय किण्वन
सुरा, आसव, मद्य, मैरेय आदि मादक पदार्थों को किण्वन विधि से तैयार करने की प्रथा बहुत पुरानी है और अच्छी सुराओं के लिए विशेष बीज-किण्व तैयार किए जाते थे, जिनकी उपस्थिति में यव, महुआ, गुड़, अंगूर के रस आदि से शराबें तैयार होती थीं। इन किण्वों के जो शराब बनाने वाले प्रेरकाणु होते हैं, उन्हें साधारण भाषा में यीस्ट कहा जाता है।
ऐरोमैटिक हाइड्रोकार्बनों के व्युत्पन्न
बेन्जीन के क्लोरिनेशन से क्लोरो व्युत्पंन, ब्रोमीनेशन से ब्रोमो व्युत्पंन, नाइट्रेशन से मोनोनाइट्रेट, डाइनाइट्रेट और ट्राइनाइट्रो व्युत्पन्न तथा सल्फोनीकरण से सल्फोनिक अम्ल व्युत्पंन प्राप्त होते हैं। फिर इनसे ऐनिलीन, फिनोल, ऐल्डिहाइड, कार्बोक्सिलिक अम्ल, सैलिसिलिक अम्ल, सैलोल, ऐस्पिरिन इत्यादि अनेक बड़े उपयोगी पदार्थ प्राप्त हो सकते हैं। एक और प्रसिद्ध यौगिक सोडियम ऐमिनोसैलिसिलेट (PAS) है, जिसका उपयोग स्ट्रेप्टोमाइसीन के साथ राजयक्ष्मा के उपचार में करते हैं। बेन्ज़ीन वलय में एक से अधिक हाइड्रॉक्सिमूलक भी संस्थापित किए जा सकते हैं और इस प्रकार डाइहाइड्रिक, ट्राइहाइड्रिक फीनोलें तैयार की जा सकती हैं। कैटिकोल कत्थे में होता है। आलू, सेब और बहुत सी तरकारियों चाकू से काटने पर काली पड़ जाती हैं। इन सब में कुछ कैटिकोल की मात्रा होती है, जो हवा के संपर्क में आक्सीकृत और बहुलीकृत होकर याम वर्ण के यौगिक देता है।
ऐल्केलॉइड
पौधों में से प्राप्त क्षारीय प्रवृत्ति के यौगिकों को पहले तो ऐल्केलॉइड कहा जाता था। अब उन सब पदार्थों को हम ऐल्केलाइड कहेंगे जिनकी प्रवृत्ति क्षारीय हो, जो वनस्पति जगत् से उपलब्ध किए गए हों और जिनमें कम से कम एक नाइट्रोजन वाला विषमचक्रीय वलय हो। क्विनीन, मॉर्फीन, सिंकोनीन आदि ओषधियाँ ऐल्केलॉइड के उदाहरण हैं।
प्रोटीन, पालिपेप्टाइड और एमिनो अम्ल
वानस्पतिक और जंतव जगत् से प्राप्त ये उपयोगी पदार्थ हैं और भोजन के परम आवयक अंग हैं। प्रोटीनों के जल अपघटन से ऐमिनों अम्ल मिलते हैं। कई ऐमिनों अम्ल मिलकर पोलिपेप्टाइड (बहु पेप्टाइड) बनाते हैं।
डाइऐज़ो यौगिक और ऐज़ो रंजक
1858 ई. में पीटर ग्रीस (Peter Griess) ने यह देखा कि ऐरोमैटिक ऐमिनो नाइट्रस अम्ल का प्रभाव उससे भिन्न है जो ऐलिफैटिक ऐमिनो पर साधारणतया देखा जाता है। उसने देखा कि ऐनिलीन नाइट्रस अम्ल (अथवा सोडियम नाइट्राइट और हाइड्रोक्लोरिक अम्ल) से क्रिया करके एक नवीन यौगिक देता है, जिसका नाम वेन्ज़ीन डाइऐज़ोनियम क्लोराइड है।
संलेषित औषिधियाँ
कार्बनिक रसायन के क्षेत्र में संलेषित यौगिकों का बड़ा सफल प्रयोग औषधियों के रूप में हुआ। वृक्ष और वनस्पतियों से प्राप्त ओषधियाँ वस्तुत: कार्बनिक ही हैं। इन औषधियों के सक्रिय अवयवों की रसायनज्ञों ने परीक्षा की। इनकी रासायनिक संरचना जानने के अनंतर उन्होंने इनका संलेषण किया और फिर इनके व्युत्पन्नों की औषधि की दृष्टि से परीक्षा की। कुछ ऐतिहासिक संलेषणों का उल्लेख निम्न है-
- (क) पूतिनाशक
1867 ई. में लिस्टर (Lister) ने फीनोल में पेतिनाशक, या रागाणुनाशक, गुण देखें। शौचालयों में 'फिनायल' का, जिसमें कोलतार से प्राप्त अवयवों का मिरण है, जैसे क्रिसोल, क्रेसिलिक अम्ल, क्रिओसोट, क्लोरोज़ाइलीनोल इत्यादि, आज तक उपयोग किया जाता है। डेटोल (Dettol) में, जिसका इतना प्रचार है, क्लोरोजाइलीनोल, टर्पिनिओल, एल्कोहॉल, और थोड़ा अंडी के तेल का सबुन है। डी. सी. एम. एक्स. (DCMX) नाम से डाइक्लोरो-ज़ाइलीनोल का उपयोग 1952 ई. से बहुत होने लगा है। कुछ रंगों का उपयोग भी चिकित्सा में पूतिनाशकों के रूप में होता है, जैसे जेनशियम वॉयलेट (क्रिस्टल वायलेट), ब्रिलिएंट ग्रीन, मेलेकाइट ग्रीन आदि, जो ट्राइफीनिल मेथेन वर्ग के रंग हैं। काष्ठ, सेलुलोस आदि से बने पदार्थों को यदि कीटाणुओं ओर कर्फूदियों स बचाना हे, तो सैलिसित ऐनिलाइड [व्यापारिक नाम शिरलान (Shirlan)] का उपयोग करों, अथवा धातु साबुनों का उपयोग करें, जैसे जिंग नैफ्थीनेट और पारद के यौगिक, पेंटाक्लोराफ़ीनोल, डाइक्लोरोफीन [डी.डी.डी.एम. (DDDM) या डी.डी.एम. (DDM): डाइहाइड्रॉक्सि डाइक्लोरो-डाइफेनिल मीथेन] आदि
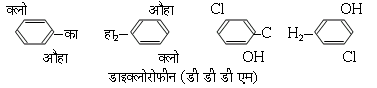
- (ख) सामान्य और स्थानिक निचेतक, या मूर्च्छोत्पादी
ईथर नामक द्रव का निचेतक के रूप में पहली बार प्रयोग हुआ और इसने प्रसव और शल्यकर्म दोनों में बड़ी सहायता दी। ईथर का क्वथनांक कम, अर्थात् 35°सेंल्सियस है। यह इसका अवगुण हैं। 1953 ई. में ट्राइफ्लोरो एथिल विनिल ईथर, काफ्लो3. काहा2. औकाहा=काहा2 (CF3. CH2. OCH=CH2), को ईथर से कहीं अधिक रेष्ठ पाया गया। क्लोरोफ़ार्म, काहाक्लो3 (CHCl3), एथिलक्लोराइड (CH3CH2Cl) और साइक्लोप्रोपेन, (काहा2)3 [(CH2)3], तो प्रसिद्ध है ही।
सामानय निचेतना या मूर्च्छा पैदा करने की अपेक्षा स्थानिक निचेतना साधारण शल्यकर्म में बड़ी उपयोगी हैं। 1884 ई. में कोलर (Koller) और फ्रॉयड (Freud) ने कोकेन का इस दृष्टि से प्रयोग किया। यह देखा गया कि पेराऐमिनो बेन्ज़ोइक अम्ल के व्युत्पन्न अच्छे स्थानिक निचेतक हैं। वेन्ज़ोकेन, ओकेन (नोवोकेन), एमीथोकेन आदि इसी वर्ग के यौगिक हैं।

- (ग) निद्राकारी
रोगी को अधिक कष्ट के समय निद्राकारियों का सेवन कराया जाता है, जिससे रोगी सो जाए। क्लोरलहाइड्रेट, [CCl3. CH(OH)2], का उपयोग इस कार्य में सबसे पुराना है। क्लोरोक्यूटोल [(CH3)2 C
(CCl3) OH.] के गुण भी क्लोरल हाइड्रेट के समान ही हैं। सबसे प्रसिद्ध निद्राकारी बार्विट्यूरिक अम्ल के व्युत्पंन हैं (यह अम्ल यूरिया और मैलोनिक अम्ल के संघनन से बनाया जाता है)।
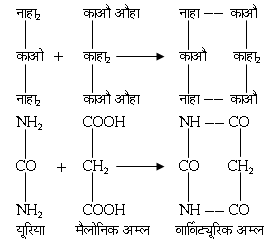 इसका द्वि ऐमिल व्युत्पंन वार्विटोन नाम से विख्यात है और एथिल फेनिल व्युत्पन्न फीनोवार्विटोन (ल्यूमिनाल) नाम से। कोडीन, मॉर्फीन आदि ऐल्कैलायड भी निद्राकारी हैं, जो अफीम से निकाले जाते हैं। मॉर्फीन से पीड़ा की अनुभूति कम हो जाती है और कोडोन शमनकारी है।
इसका द्वि ऐमिल व्युत्पंन वार्विटोन नाम से विख्यात है और एथिल फेनिल व्युत्पन्न फीनोवार्विटोन (ल्यूमिनाल) नाम से। कोडीन, मॉर्फीन आदि ऐल्कैलायड भी निद्राकारी हैं, जो अफीम से निकाले जाते हैं। मॉर्फीन से पीड़ा की अनुभूति कम हो जाती है और कोडोन शमनकारी है।
- (घ) तंत्रोत्तेजक
स्नायुओं और मस्तिष्क की तंत्रिकाओं को उत्तेजन देने वाली चीजों में चाय, काफ़ी आदि प्रसिद्ध हैं। इनमें कैफीन, ज़ैन्थीन और इनसे मिलते जुलते प्यूरीन (Purine) वर्ग के यौगिक पाए जाते हैं। कोला के बीजों में कैफीन और थिओब्रोमीन होता है। एरगोट (Ergot) वर्ग के ऐल्कैलायडों में पेशियों को उत्तेजित करने का गुण है। ये ऐल्कैलॉइड लिसर्गिक अम्ल (lysergic acid) के व्युत्पन्न हैं। यह अम्ल अब संलेषित कर लिया गया है। मस्तिष्क के विकारों के उपचार में इससे सहायता मिलती है।
- (ङ) ज्वरनाशी और वेदनानाशी
ज्वर से ग्रस्त रोगी के शरीर का ताप जिन ओषधियों से कम हो जाए (ज्वर का कारण चाहे दूर न हो), वे इस वर्ग में आती हैं। कुछ औषधियाँ केवल वेदना दूर करती हैं। सैलिसिलिक अम्ल, ज्वरहारियों में, सबसे पुराना है। इसका एक ऐसीटिल व्युत्पन्न ऐस्पिरिन है, जो शिर पीड़ा की अनुभूति दूर करने में बड़ा उपयोगी सिद्ध हुआ है। फिनैसीटिन में ज्वर के ताप को कम कर देने के अच्छे गुण हैं। फिनैसिटीन ऐसीटो ऐनिलाइड का व्युत्पन्न है।
- (च) सल्फोनैमाइड और सल्फोन
1930 ई. में यह देखा गया कि प्रोंटोसिल (prontosil) नामक लाल रंग में शाकाणु या जीवाणु के मारने के गुण विद्यमान हैं। बाद को देखा गया कि एक सरल यौगिक सल्फऐनिलैमाइड में भी जीवाणु मारने के गुण हैं। तब से इस वर्ग के सैकड़ों यौगिकों और व्युत्पन्नों की इस दृष्टि से परीक्षा की गई। ये सब यौगिक सल्फोनैमाइड वर्ग के कहे जाते हैं।
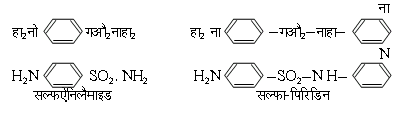 एफीड्रिन (ephedrine), का6हा5काहा(औहा) -काहा (नाहा काहा3) [C6H5. CH(OH). CH(NHCH3). CH3], और ऐड्रिनैलिन (adrenaline), (औहा)2का6हा4-काहा (औहा) काहा2.नाहा.काहा3 [(OH)2 C6H4-CH (OH) CH2. NH. CH3], का उपयोग भी तंत्रोत्तेजना के सल्फा पिरिडिन, एम ऐंड बी 693 (M & B 693) नाम से विख्यात है। पिरिमिडिन व्युत्पन्न भी (जैसे सल्फडाइऐज़ीन) बड़े गुणकारी सिद्ध हुए हैं।
एफीड्रिन (ephedrine), का6हा5काहा(औहा) -काहा (नाहा काहा3) [C6H5. CH(OH). CH(NHCH3). CH3], और ऐड्रिनैलिन (adrenaline), (औहा)2का6हा4-काहा (औहा) काहा2.नाहा.काहा3 [(OH)2 C6H4-CH (OH) CH2. NH. CH3], का उपयोग भी तंत्रोत्तेजना के सल्फा पिरिडिन, एम ऐंड बी 693 (M & B 693) नाम से विख्यात है। पिरिमिडिन व्युत्पन्न भी (जैसे सल्फडाइऐज़ीन) बड़े गुणकारी सिद्ध हुए हैं।
- (छ) मलेरियानाशी
कुछ औषधियाँ मलेरिया ज्वर दूर करने में बड़ी गुणकारी सिद्ध हुई हैं। सिनकोना की छाल से प्राप्त क्विनीन का नाम तो विख्यात है ही, इसका प्रचार अब भी बहुत है। 1920 ई से इस बात का प्रयत्न जर्मनी में होता रहा कि मलेरिया ज्वर को दूर करने की और भी औषधियाँ प्राप्त की जाएँ। फलत: पेमाक्विन नामक यौगिक इस बात में सफल पाया गया (1924 ई.)। यह प्रथम संलेषित मलेरियानाशी था। 1930 ई. में एट्रीबिन (मेपाकिन और क्विनाक्रिन) भी अच्छे पाए गए। पेमाक्विन क्विनोलिन वर्ग का यौगिक है और मेपाक्रिन पीला एक्रिडिन रंग है। गत महायुद्ध में ज़िन मलेरियानाशियों पर अमरीका में विशेष अनुसंधान हुए, उनमें प्रेमाक्विन और क्लोरोक्विन विशेष महत्व के पाए गए। पैलूड्रिन (Paludrine) प्रोग्वानिल हाइड्रोक्लोराइड का व्यापारी नाम है, यह भी मलेरिया रोग में काम आता है।
- (ज) ऐंटिबायोटिक
1928 ई. में सर ऐलेग्जेंडर फ्लेमिंग (A. Fleming) ने देखा कि कुछ वैक्टीरिया विशेष फफूँदियों की विद्यमानता में मरने लगते हैं। इसी परंपरा में पेनिसिलिन का आविष्कार हुआ। 1946 ई. में पेनिसिलिन के बेन्ज़िल व्युत्पंन (पेनिसिलिन-g) का संलेषण भी कर लिया गया। इसकी रासायनिक संरचना निम्न है:
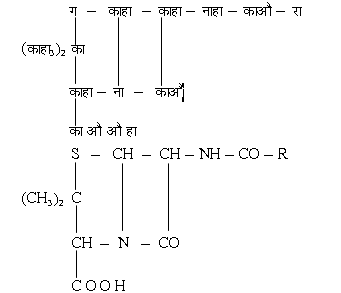 पेनिसिलिन की सामान्य संरचना पेनिसिलिन जी में, रा=का6 हा5 काहा2 (R=C6H5 CH2), बेन्जिल मूलक है। दूसरे मूलक भी प्रतिस्थापित किए जा सकते हैं। भूमि, या मिट्टी के भीतर पाए जाने वाले अनेक सूक्ष्म जीवाणुओं का परीक्षण किया गया। सबसे पहली बार 1939 ई. में ड्यूबॉस (Dubos) को सफलता मिली और उसने वैसिलस ब्रेविस (Bacillus brevis) नामक जीवाणु में से ग्रैमिसिडिन (Gramicidin) नामक पदार्थ प्राप्त किया जो पॉलिपेप्टाइडों का मिरण था। 1944 ई. में स्ट्रेप्टोमाइसीज़ ग्रिसियस (Streptomyces griseus) नाम जीवाणु का पता चला, जो राजयक्ष्मा के प्रति भी क्रियाशील था। 1947 ई. में वेनिज़्वीला में एक जीवाणु का पता चला, जिससे क्लोरैफेनिकोल (Chloramphenicol) नाक यौगिक प्राप्त किय गया। इस प्रकार ऐसे ऐंटिबायोटिक द्रव्य का पता चला जो अनेक रोगों में अकेले ही का आ सकता था। इन सब अध्ययनों के फलस्वरूप क्लोरोमाइसेटिन का संलेषण किया गया। प्रोफेसर डुग्गर (Duggar) ने उस जीवाणु का पता चलाया जो एक सुनहरे रंग का पदार्थ भी देता था और जिसका नाम स्ट्रेप्टोमाइसीज़ ऑरिओफेसियन्स (Streptomyces aureofaciens) था। इस जीवाणु से जो पदार्थ मिला उसे अॅरिओमाइसीन (Aureomycin) नाम से प्रयोग में लाया गया। 1949 ई. में नेओमाइसीन (Neomycin) की खोज वैक्समैन और लेकेवेलियर (Waksman and Lechevalier) ने की। टेरामाइसीन (Terramycin) का आविष्कार बाद में फिजर समुदाय की प्रयोगशालाओं में हुआ। इस प्रकार पेनिसिलिन यग का आरंभ हुआ।[1]
पेनिसिलिन की सामान्य संरचना पेनिसिलिन जी में, रा=का6 हा5 काहा2 (R=C6H5 CH2), बेन्जिल मूलक है। दूसरे मूलक भी प्रतिस्थापित किए जा सकते हैं। भूमि, या मिट्टी के भीतर पाए जाने वाले अनेक सूक्ष्म जीवाणुओं का परीक्षण किया गया। सबसे पहली बार 1939 ई. में ड्यूबॉस (Dubos) को सफलता मिली और उसने वैसिलस ब्रेविस (Bacillus brevis) नामक जीवाणु में से ग्रैमिसिडिन (Gramicidin) नामक पदार्थ प्राप्त किया जो पॉलिपेप्टाइडों का मिरण था। 1944 ई. में स्ट्रेप्टोमाइसीज़ ग्रिसियस (Streptomyces griseus) नाम जीवाणु का पता चला, जो राजयक्ष्मा के प्रति भी क्रियाशील था। 1947 ई. में वेनिज़्वीला में एक जीवाणु का पता चला, जिससे क्लोरैफेनिकोल (Chloramphenicol) नाक यौगिक प्राप्त किय गया। इस प्रकार ऐसे ऐंटिबायोटिक द्रव्य का पता चला जो अनेक रोगों में अकेले ही का आ सकता था। इन सब अध्ययनों के फलस्वरूप क्लोरोमाइसेटिन का संलेषण किया गया। प्रोफेसर डुग्गर (Duggar) ने उस जीवाणु का पता चलाया जो एक सुनहरे रंग का पदार्थ भी देता था और जिसका नाम स्ट्रेप्टोमाइसीज़ ऑरिओफेसियन्स (Streptomyces aureofaciens) था। इस जीवाणु से जो पदार्थ मिला उसे अॅरिओमाइसीन (Aureomycin) नाम से प्रयोग में लाया गया। 1949 ई. में नेओमाइसीन (Neomycin) की खोज वैक्समैन और लेकेवेलियर (Waksman and Lechevalier) ने की। टेरामाइसीन (Terramycin) का आविष्कार बाद में फिजर समुदाय की प्रयोगशालाओं में हुआ। इस प्रकार पेनिसिलिन यग का आरंभ हुआ।[1]
|
|
|
|
|
|
टीका टिप्पणी और संदर्भ
- ↑ रसायन विज्ञान (हिन्दी) भारतखोज। अभिगमन तिथि: 14 फरवरी, 2015।